研究过程中SAE报告的SOP
Ⅰ. 目的:确保试验受试者发生严重不良事件时,获得及时救治,并按我国药物临床试验相关法规进行SAE的申报。
Ⅱ. 范围:适用于本机构严重不良事件的报告。
Ⅲ. 规程:
1. 定义
严重不良事件(Serious Adverse Event),是指临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。引自《药物临床试验质量管理规范》(局令第3号)
除依据上述规范所界定的SAE外,如试验方案做出额外规定的SAE或妊娠等应同时遵循本SOP进行上报。
2. 处理与记录
2.1 当受试者发生SAE时,如在当地,无法返回我院就诊的,嘱其在当地大型医院住院诊治,病情稳定后尽快回我院治疗;如受试者在广州,立即要求患者返我院给予救治;
2.2如为双盲试验,按揭盲操作的SOP进行,必要时,派出研究医师携随机信封到当地揭盲,并根据入组情况给予治疗;
3. 紧急揭盲
发生重要不良事件,在抢救受试者时,需立即查明所服药品的种类,由主要研究者决定紧急揭盲。一旦揭盲,该患者将被中止试验,同时将处理结果通知临床监查员。研究人员还应在CRF中详细记录揭盲的理由、日期并签字。
4. 相关性判断
主要研究者按照《不良事件及严重不良事件处理的SOP》有关章节,对SAE与研究药物的相关性进行判断,必要时可邀请有关专家和SAE专员参与。
5. 报告流程
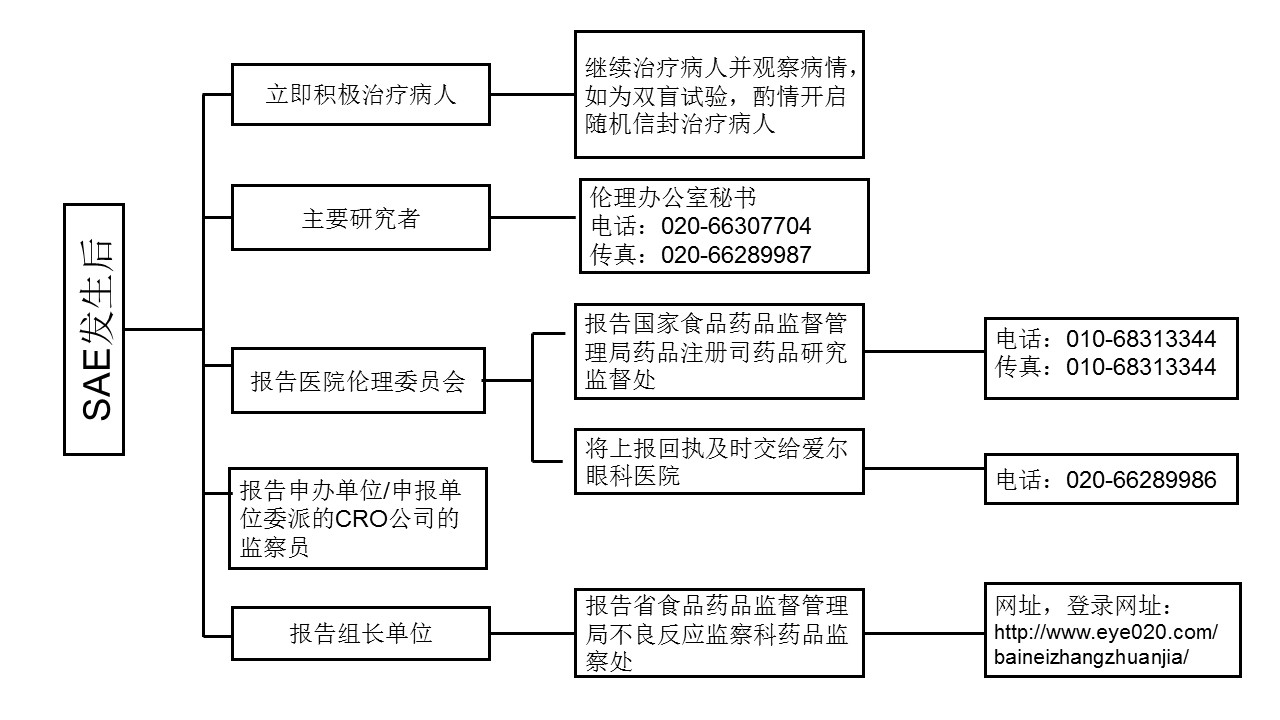
5.1报告时限:研究者在获知受试者出现SAE时,应及时通知主要研究者(PI)按方案、项目SOP及时进行处理,并在24小时内报告GCP机构SAE专员(020-61897168),并向有关部门报告。
5.2 报告部门:申办单位,组长单位,本院伦理委员会,国家食品药物监督管理局,省食品药物监督管理局;如为组长单位,还需向参加单位进行通报。
5.3 报告方式:研究者填好“SAE报告表”之后,由CRC或者项目组研究者按照SAE上报流程上报,并将上报结果报告至爱尔眼科医院药物临床试验机构,或者要求接收单位在接到SAE报告后,将“回执”传真至020-61897168处爱尔眼科医院药物临床试验机构接收。较后“SAE报告表”原件、“SAE报告回执”、 “SAE报告传真回执”归入研究者档案夹,并提交SAE报告表电子版到机构办公室,由机构SAE专员进行集中登记。相关表格参考附件。
6. 追踪随访
6.1 如SAE发生转归或距发生之日相隔30日,需填报随访报告或总结报告。
6.2 如判断与试验药物相关的SAE,必须随访至该事件出现转归、结束或病人失访;如判断与试验药物不相关的SAE,必须随访至该事件出现后的28天;如因妊娠上报SAE的,应随访至胎儿出生,观察有无致畸、致残等事件发生。
SAE上报流程参考下图:
 Ⅳ. 参考依据:《药物临床试验质量管理规范》
Ⅳ. 参考依据:《药物临床试验质量管理规范》
Ⅴ. 附件:
附件1爱尔眼科医院药物临床试验机构SAE报告回执
附件2严重不良事件报告表(SAE)
附件3爱尔眼科医院药物临床试验机构SAE报告传真回执
Ⅱ. 范围:适用于本机构严重不良事件的报告。
Ⅲ. 规程:
1. 定义
严重不良事件(Serious Adverse Event),是指临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。引自《药物临床试验质量管理规范》(局令第3号)
除依据上述规范所界定的SAE外,如试验方案做出额外规定的SAE或妊娠等应同时遵循本SOP进行上报。
2. 处理与记录
2.1 当受试者发生SAE时,如在当地,无法返回我院就诊的,嘱其在当地大型医院住院诊治,病情稳定后尽快回我院治疗;如受试者在广州,立即要求患者返我院给予救治;
2.2如为双盲试验,按揭盲操作的SOP进行,必要时,派出研究医师携随机信封到当地揭盲,并根据入组情况给予治疗;
3. 紧急揭盲
发生重要不良事件,在抢救受试者时,需立即查明所服药品的种类,由主要研究者决定紧急揭盲。一旦揭盲,该患者将被中止试验,同时将处理结果通知临床监查员。研究人员还应在CRF中详细记录揭盲的理由、日期并签字。
4. 相关性判断
主要研究者按照《不良事件及严重不良事件处理的SOP》有关章节,对SAE与研究药物的相关性进行判断,必要时可邀请有关专家和SAE专员参与。
5. 报告流程
5.1报告时限:研究者在获知受试者出现SAE时,应及时通知主要研究者(PI)按方案、项目SOP及时进行处理,并在24小时内报告GCP机构SAE专员(020-61897168),并向有关部门报告。
5.2 报告部门:申办单位,组长单位,本院伦理委员会,国家食品药物监督管理局,省食品药物监督管理局;如为组长单位,还需向参加单位进行通报。
5.3 报告方式:研究者填好“SAE报告表”之后,由CRC或者项目组研究者按照SAE上报流程上报,并将上报结果报告至爱尔眼科医院药物临床试验机构,或者要求接收单位在接到SAE报告后,将“回执”传真至020-61897168处爱尔眼科医院药物临床试验机构接收。较后“SAE报告表”原件、“SAE报告回执”、 “SAE报告传真回执”归入研究者档案夹,并提交SAE报告表电子版到机构办公室,由机构SAE专员进行集中登记。相关表格参考附件。
6. 追踪随访
6.1 如SAE发生转归或距发生之日相隔30日,需填报随访报告或总结报告。
6.2 如判断与试验药物相关的SAE,必须随访至该事件出现转归、结束或病人失访;如判断与试验药物不相关的SAE,必须随访至该事件出现后的28天;如因妊娠上报SAE的,应随访至胎儿出生,观察有无致畸、致残等事件发生。
SAE上报流程参考下图:

Ⅴ. 附件:
附件1爱尔眼科医院药物临床试验机构SAE报告回执
附件2严重不良事件报告表(SAE)
附件3爱尔眼科医院药物临床试验机构SAE报告传真回执
 |
3个附件 |
- 上一篇:非注册类临床试验运行管理制度和流程
- 下一篇:药物临床试验运行管理制度和流程



